Набор для определения апоптотических клеток содержит все необходимые реагенты для мечения апоптотических и некротических клеток с помощью аннексина V, конъюгированного с AF488, и йодистого пропидия.
AF488 — сульфированный родамин, яркий, фотостабильный и гидрофильный флуорофор. Краситель излучает в зеленом (FITC) канале.
- Максимум поглощения, нм — 495;
- максимум эмиссии, нм — 519.
Йодистый пропидий (PI) — непроницаемый через плазматическую мембрану ДНК-краситель, позволяющий различать популяции некротических, апоптотических и здоровых клеток на основе целостности мембраны. После связывания с ДНК краситель излучает в оранжево-красном канале.
- Максимум поглощения, нм — 535;
- максимум эмиссии, нм — 617.
Состав набора для определения апоптотических клеток с помощью аннексина V-AF488
- Аннексин V, AF488 конъюгат, мкг – 5;
- Propidium Iodide solution, 0,1 мг/мл, мкл – 100;
- Annexin V Binding Buffer, 5x, мл – 15.
Условия транспортировки и хранения
- Транспортировка – до трех недель при комнатной температуре;
- хранение, °С – -20°С;
- срок хранения – 12 месяцев.
Рекомендуемые концентрации аннексина V-AF488 — от 2 до 5 мкг/мл, в зависимости от исследуемой клеточной культуры. Перед экспериментом необходимо опробовать разные разведения аннексина V-AF488 для определения оптимальной концентрации.
Окрашивание с помощью йодистого пропидия — опционально. Этот этап можно пропустить, если в задачах нет необходимости исследовать некроз.
Важно! Аннексин V можно использовать в качестве маркера апоптоза только в клетках с интактной плазматической мембраной. При нарушении целостности плазматической мембраны аннексин V может связываться с ФС внутри клетки и давать ложноположительный результат.
Применение набора для определения апоптотических клеток с помощью аннексина V-AF488
Приготовление растворов
1. Растворите содержимое пробирки с лиофилизированным аннексином V-AF488 в 250 мкл деионизованной воды.
Важно! Разведенный рекомбинантный белок необходимо хранить защищенным от света при температуре 2-8°C. В растворе конъюгат стабилен в течение месяца. При длительных экспериментах рекомендуется приготовить аликвоты и хранить их при температуре −20°С. Избегать повторного замораживания!
2. Приготовьте необходимый объём 1х буфера для связывания, смешав 1 часть 5х буфера для связывания с 4 частями деионизованной воды.
Окрашивание клеток
1. Адгезированные клетки аккуратно снимите с поверхности роста подходящим способом. С суспензионными клетками начинайте работу со следующего пункта.2. Промойте клетки один раз охлаждённым PBS (рН7.4) и один раз 1х буфером для связывания.
3. Ресуспензируйте клетки в холодном 1х буфере для связывания.
4. Отберите 100 мкл суспензии клеток (от 1×105 до 1×106 клеток/мл) в микроцентрифужные пробирки объемом 1.5 мл. Для проточной цитометрии необходимо заготовить дополнительные пробирки с соответствующими контролями (см. описание контролей ниже).
5. Добавьте 2-5 мкл раствора аннексина V-AF488 в каждую пробирку, инкубируйте в течение 10-15 мин при комнатной температуре в защищенном от света месте.
6. Без предварительной отмывки добавьте 400 мкл 1x буфера для связывания в каждую пробирку.
7. (Опционально) Добавьте 5 мкл йодистого пропидия в каждую пробирку с клетками. Аккуратно перемешайте содержимое пробирки и инкубируйте в течение 5 мин при комнатной температуре в защищенном от света месте.
Важно! Не промывайте клетки от йодистого пропидия. Йодистый пропидий должен оставаться в буфере во время сбора данных.
8. Окрашенные клетки храните при температуре 2-8°C в защищенном от света месте до проведения анализа.
Важно! Количественное определение клеток методом проточной цитометрии или флуоресцентной микроскопии необходимо производить в течение 4 ч от начала окрашивания из-за негативного воздействия йодидистого пропидия на жизнеспособность клеток.
Проточная цитометрия
1. Для цитофлуориметрического анализа апоптоза и некроза клеток с помощью аннексина V-AF488 и йодистого пропидия помимо целевого окрашивания необходимо приготовить контроли: неокрашенные клетки (отрицательный контроль для настройки прибора); клетки, окрашенные только аннексином V-AF488, и клетки, окрашенные только йодистым пропидием (для настройки компенсации).
2. Анализ связывания аннексина V-AF488 проводят с использованием детектора сигнала FITC.
3. Анализ клеток, окрашенных йодистым пропидием, осуществляют с помощью детектора сигнала фикоэритрина.
Флуоресцентная микроскопия
1. Отберите каплю суспензии с окрашенными клетками и поместите ее на предметное стекло. Накройте клетки покровным стеклом.
2. В качестве альтернативы, адгезированные клетки можно окрашивать непосредственно на покровном стекле. После окрашивания переверните покровное стекло на предметное, так, чтобы клетки находились между предметным и покровным стёклами.
3. (Опционально) Клетки после окрашивания аннексином V, перед визуализацией можно промыть 1х буфером для связывания и зафиксировать в 2% параформальдегиде. Не фиксируйте клетки перед инкубацией с аннексином V-AF488, поскольку любое нарушение клеточной мембраны может вызвать неспецифическое связывание аннексина V с ФС на внутренней поверхности клеточной мембраны.
4. Исследование клеток под флуоресцентным микроскопом осуществляют, используя двойной набор фильтров для FITC и родамина.
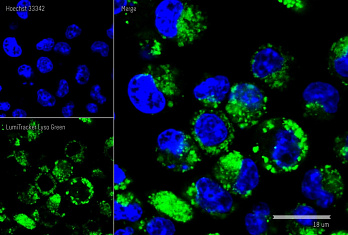
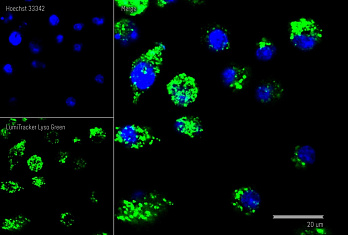
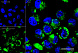
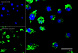
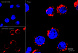
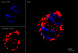
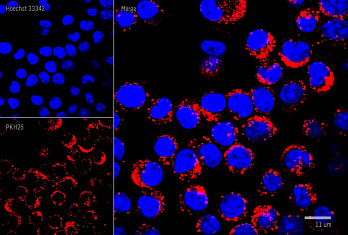
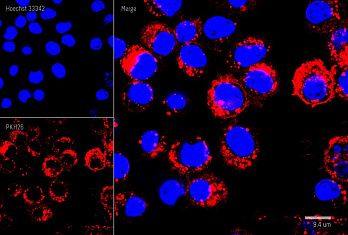
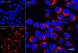
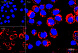
Результат окрашивания
- Ранние апоптотические клетки, связавшие аннексин V-AF488, окрашиваются в зеленый цвет в плазматической мембране.
- Некротические клетки в результате проникновения йодистого пропидия внутрь клетки будут окрашены красным.
- Апоптотические клетки с нарушенной в результате вторичного некроза целостностью мембраны будут иметь красное окрашивание (йодистый пропидий) и ореол зеленого окрашивания (AF488) на клеточной поверхности (плазматическая мембрана).
- Здоровые клетки будут лишены окрашивания.